Jumpa lagi bersama mimin yang pada kesematan yang baik ini akan memagikan informasi mengenai pengertian atom. Yuk langsung saja kita simak artikel berikut ini.
Pengertian Atom
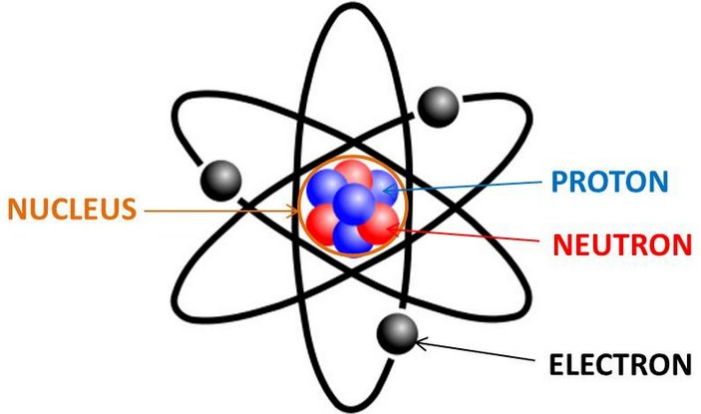
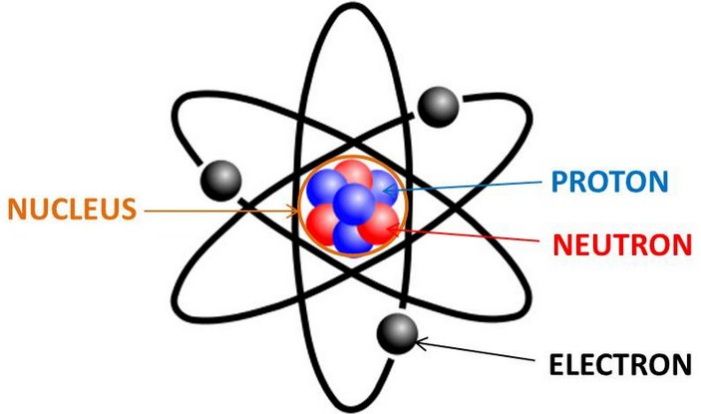
Atom adalah suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya.
Kata atom berasal dari bahasa Yunani, yaitu dari kata “Atomos” yang artinya tidak dapat dibagi-bagi.
Inti atom terdiri dari proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak mempunyai neutron). Atom mempunyai diameter sekitar 6-30 nm.Karena adanya gaya elektromagnetik, atom bergabung bersama dengan atom-atom yang lain sehingga membentuk sebuah molekul.
Pengertian Atom Menurut Para Ahli
Berikut adalah beberapa ahli yang mendefinisikan pengertian atom adalah:
Bohr
Kegagalan dari teori Rutherford, mengundang seorang ilmuwan bernama Bohr untuk mencoba melengkapi sekaligus memperbaiki sisi lemah dari teori sebelumnya dengan tiga ketentuan, yaitu :
- Kententuan pertama seputar rotasi yang dibuat elektron dengan mengelilingi inti dengan sebutan lintasa stasioner.
- Ketentuan kedua mengatakan bahwasanya elektron memiliki kemampuan untuk melakukan perpindahan dari satu lintasan ke lintasan yang lain sesuai dengan rotasi yang ada.
- Lintasan-lintasan yang diperkenankan elektron adalah lintasan-lintasan yang mempunyai momentum sudut kelipatan bulat.
Demokritos
Demokritos berendapat bahwa atom adalah kumpulan partikel kecil dalam jumlah banyak kemudian melekati dan menyusun hampir seluruh materi yang ada di alam semesta. Dalam kata lain teori ini menyebutkan jika materi yang ada di bumi dan isinya merupakan bagian dari unsur atom.
Ernest Rutherford
Atom adalah bagian partikel yang memiliki inti atau yang biasa disebut dengan “Inti Atom”. Didalam inti atom terdapat dua partikel yang dikenal dengan proton dan neutron.
J. Desaulx
Ia adalah Salah satu Fisikawan yang berasal dari Jean Perrin. Ia telah melakukan eksperimen mengenai masa atom dan juga turut menuturkan pendapatnya tentang teori atom dengan menggunakan percobaan dari karya buatan Einstein yang kemudian digunakan untuk mengujicoba besaran masa dan atom pada sebuah katoda.
J.J. Thomson
Goyahnya teori atom oleh Dalton secara tak langsung disebabkan karena adanya kehadiran Teori baru oleh Ilmuwan bernama J.J Thomson. Ia berpendapat bahwa atom lebih diibaratkan seperti bola yang memiliki kemampuan energi ataupun muatan positif dan negatif seperti pada proton dan neutron dan juga mampu menyebar secara merata.
John Dalton (1803)
Menurutnya alasan unsur dapat selalu bereaksi seperti halnya sifat gas yang selalu larut dalam air ketimbang gas lain yang tentunya didalamnya terdapat fungsi atom yang kemudian dijelaskan lebih dalam bahwasanya pada setiap elemen yang memiliki unsur atom dengan sifat tunggal dinyatakan dapat bergabung dengan bentuk senyawa kimia lainnya.
Lavoisier
Pada tahun 1789 Lavoiser mengemukakan pengertian atom dengan istilah unsur yang merupakan salah satu bahan dasar yang memiliki kemampuan yakni tak dapat dibagi lagi meskipun dianalisa dengan menggunakan metode kimia.
Robert Boyle
Menurut Robert Boyle pada tahun 1661 beliau mengemukakan pengertian atom dengan meluncurkan buku yang berjudul “The Sceptical Chymist”.Didalam bukunya berisi tentang teori atom dimana dunia dan isinya (materi yang terkandung didalamnya) adalah hasil bentukan dari kombinasi beragam atom yang berbeda.
Stern Gerlach
Teori atom terus berkembang hingga pada tahun 1922, seorang Ilmuwan bernama Stern Gerlach mengemukakan pendapatnya tentang pengertian atom dari hasil penelitiannya membuktikan bahwasanya atom memiliki sifat yang kauntum.
Hal tersebut didapat dari uji coba yang telah dilakukan saat sinar atom perak diberikan sedikit tekanan melalui medan magnet yang kemudian data/benda tersebut digerakan secara terpisah hingga membentuk sudut spin lalu hasilnya bagian berkas tersebut bergerak menyebar tak menentu yang menghasilkan kesimpulan tergantung pada spin atom tersebut melintas apakah keatas atau kebawah.
Sejarah Penemuan Atom
Sejarah penemuan atom dimulai pada tahun 1803 oleh John Dalton yang pada saat itu mengemukakan sebuah teori tentang atom.Kemudian, banyak ilmuwan yang mendukung teori atom yang dilakukan oleh John Dalton seperti, Michael Faraday seorang yang telah menemukan teori pemecahan molekul menggunakan elektrolisis pada tahun 1832, dan J.Plucker yang menemukan tabung katoda pada tahun 1839.
Setelah itu diikuti dengan penemuan oleh Dmitri Mendelev mengenai hukum periodic pada tahun 1869. John C.Maxwell tahun 1873 yang melakukan penelitian tentang listrik dan medan listrik.
Kemudian Sir Willian Crookes pada tahun 1870 melalui penelitian eksperimental menemukan suatu electron memiliki massa tertentu melalui percobaan penembakan sinar katoda.
Dilanjutkan penelitian yang dilakukan oleh E.Goldstein, ia menemukan proton bermuatan positif. Lalu G.J Stoney yang telah berhasil menemukan partikel penyusun atom bermuatan negative yakni electron. Dan penelitian oleh Wilhelm Roentgen yang menemukan X-Ray.
Rutherford lalu membuat hipotesis berdasarkan penelitiannya yang mengemukakan bahwa terdapat suatu inti atom selain proton yang menjaga keseimbangan atom. Hipotesis Rutherford tersebut kemudian dibuktikan oleh James Chadwik tahun 1932 dengan menemukan partikel atom yang bermuatan netral yang disebut dengan neutron.
Baca Juga : Pengertian T-Shirt atau Kaus Oblong !
Teori-Teori Atom
Teori atom sering berubah menurut penelitian-penelitian yang telah berkembang. Seorang ahli filsafat dari Yunani Demokritusmengemukakan bahwa sebuah materi bersifat diskontinu, jika materi tersebut dibelah secara terus-menerus, maka akan didapatkan bagian yang tidak dapat dibelah lagi. Bagian tersebut dinamakan dengan atom.
Berikut ini adalah beberapa teori tentang atom adalah :
Teori Atom Dalton
Teori ini dikemukakan oleh John Dalton ditahun 1803 M. John Dalton berpendapat berdasarkan dua hukum yang diambil, yakni hukum kekekalan massa (Lavoisier) dan hukum susunan tetap (hukum Prouts).
Dalam hukum kekekalan massa, lavosier menjelaskan bahwa “massa total zat-zat sebelum reaksi sama dengan massa total zat-zat hasil reaksi”. Begitu juga dengan hukum susunan tetap, Prouts menjelaskan bahwa “perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum tersebut, maka Dalton menarik kesimpulannya yakni :
- Atom merupakan bagian terkecil materi yang tidak dapat dibagi lagi
- Atom berbentuk mirip seperti bola pejal yang snagat kecil, suatu atom memiliki unsur-unsur memiliki atom-atom yang identikdan berbeda dengan unsur yang berbeda
- Atom-atom jika bergabung maka akan membentuk suatu senyawa dengan perbandingan bilangan bulat dan sederhana.
- Reaksi kimia merupakan pemisahan ataupun penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Teori atom Dalton tersebut menimbulkan satu kelemahan, yakni tidak bisa menjelaskan bagaimana suatu materi dapat menghantarkan listrik. Bagaimana mungkin sebuah bola pejal menghantarkan listrik, sebab listrik itu dihantarkan oleh electron yang bergerak.
Teori Atom Thomson
Teori jenis ini dikemukakan oleh Joseph John Thomson. Awalnya dari penemuan tabung katode oleh William Crooker, maka Thompson lalu meneliti lebih lanjut tentang sinar katode. Joseph John Thomson menemukan bahwa sinar katode adalah sebuah partikel, karena sinar ini bisa memutar baling-baling yang diletakkan antara katode dan anode.
Dari hasil inilah Joseph John Thomson menyusun kesimpulan bahwa sinar katode adalah partikel penyusun atom yang bermuatan negative yang disebut dengan electron.
Selanjutnya, Joseph John Thomson berpendapat bahwa atom adalah partikel yang bersifat netral, sebab electron bermuatan negative, maka harus ada suatu partikel lain yang mampu menteralkan hal tersebut, yakni partikel positif.
Teori atom Thomson menjelaskan “Atom merupakan partikel yang berbentuk seperti bola pejal dengan muatan positif, dan dialamnya tersebar muatan negatif”. Bola atom ini bisa diumpakan seperti jambu biji yang terkelupas kulitnya. Electron di dalam atom persis seperti biji jambu yang tersebar merata di dalam jambu. Teori Thompson ini memperbaiki kelemahan dari teori atom Dalton sebeumnya.
Teori Atom Rutherford
Rutherford dibantu oleh dua orang muridnya yakni, Hans Geigerden dan Erners Masreden. Mereka melakukan percobaan yang dikenal dengan sebutan hamburan sinar alfa di suatu lempeng emas tipis.
Sebelum melakukan percobaan tersebut, terlebih dahulu telah ditemukan partikel alfa yang mempunyai sifat positif dan bergerak lurus, serta berdaya tembus besar, sehingga dapat menembus lembaran tipis emas.
Dari hasil penelitian, mereka menemukan penemuan ketika ditembakkan sinar alfa ke lempengan tipis emas, maka sebagian partikel alfa akan diteruskan (walaupun terdapat penyimpangan sudut kurang dari 1`), akan tetapi dari pengamatan Marsden ditemukan satu dari 20.000 partikel alfa akan membelok dengan sudut 90` atau bahkan lebih.
Kesimulan dari teori atom Rutherford adalah :
- Atom bukan berbentuk bola pejal, karena hampir semua partikel alfa diteruskan.
- Jika lempeng emas itu dianggap sebagai lapisan atom-atom emas, maka di dalam atom emas didapat partikel yang sangat kecil bermuatan positif.
- Partikel positif itu merupakan partikel penyusun inti atom, dan ukuran inti atom lebih kecil 10.000 kali dari ukuran atom.
Teori Atom Bohr
Seorang pakar fisika, Neils Bohr pada tahun 1913 berusaha untuk memperbaiki teori yang dikemukakan sebelumnya oleh Rutherford. Bohr melakukan sebuah percobaan yang dikenal dengan sebutan spectrum atom hydrogen.
Dalam percobaan tersebut, Bohr berhasil menemukan sebuah gambaran mengenai bagaimana keadaan electron yang menempati daerah inti atom. Teori Bohr menggabungkan antara teori mekanika kuantum yang ditemukan oleh Planck dengan teori Rutherford yang ditemukan oleh Rutherford. Selanjutnya, Bohr mengungkapkan empat postulatnya, yakni :
- Hanya ada seperangkat orbit tertentu yang boleh bagi satu electron dalam satu atom hydrogen. Orbit ini dikenal dengan orbit stationer (menetap) electron dan merupkaan lintasan melingkar di sekeliling inti
- Selama electron berada di lintasan stationer, energy elektorn akan tetap sehingga tidak ada energy dalam bentuk radiasi yang dipancarkan atau diserap
- Elektron dapat berpindah dari satu lintasan stationer ke lintasan stationer yang lain. Perpindahan ini juga akan memakan energy sesuai dengan persamaan Plank E2-E1 =hf
- Lintasan stationer yang dibolehkan memiliki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut.
Selain mengungkapkan empat postulatnya, Bohr juga mengemukakan bahwa electron-elektron mengelilingi inti pada lintasan-lintasan tertentuyang disebut dengan kulit electron atau kulit energy. Tingkat energy yang paling rendah ialah kulit electron yang paling dalam, dan semakin besar nomor kulitnya, maka semakin besar tingkat energinya.
Baca Juga : Pengertian O2SN, Tujuan dan Cabang Perlombaan !
Partikel Dasar Atom
Partikel dasar atom terdiri dari proton, neutron dan elektron. Partikel dasar ini tidak terlepas dari adanya pengaruh gaya elektromagnetik yang mengikat partikel-pertikel ini. Pengertian dari proton, neutron, dan elektron pada partikel dasar suatu atom yaitu, sebagai berikut.
Proton
Proton adalah partikel dasar yang memiliki muatan positif (+1) dan memiliki diameter hanya 1/3 diameter electron. Tetapi, proton mempunyai massa sekitar 1840 kali electron.
Neutron
Neutron adalah partikel dasar yang tidak memiliki muatan (netral), dan mempunyai massa yang sama dengan gabungan antara massa proton dan massa electron.
Elektron
Elektron adalah partikel dasar yang mempunyai muatan negative (-1) dan memiliki massa paling ringan diantara partikel lainnya yang hanya 1/1840 kali massa proton atau neutron.
Partikel-Partikel Atom
Berikut adalah partikel-artikel atom, yakni :
Partikel Subatom
Meskipun definisi atom menjelaskan bahwa atom adalah bagian terkecil dari material yang tidak dapat dibagi lagi, namun dalam ilmu modern, atom sendiri tersusun dari beberapa partikel subatom. Partikel subatom tersebut meliputi proton, elektron dan neutron.
Inti Atom
Inti atom terdiri atas proton dan neutron yang terikat di inti atom oleh suatu gaya elektromagnetik. Proton dan nutron ini disebut nucleon atau penyusun inti.
Inti atom memuyai diameter sekitar 10-15 nm. Atom dari unsur kimia yang sama mempunyai jumlah proton yang sama pula. Suatu unsur bisa mempunyai variasi jumlah neutron yang disebut isotop.
Awan Elektron
Awan partikel adalah suatu daerah dalam sumur potensi dimana tiap-tiap electron menghasilkan sejenis gelombang diam (gelombang yang tidak bergerak).
Sifat-Sifat Atom
Berikut adalah sifat-sifat atom adalah :
Sifat Nuklir
Sifat nuklir atau radioaktif hanya dimiliki oleh unsur-unsur atom yang mempunyai nomor atom lebih dari 82. Dari sekitar 339 nuklida yang telah ditemukan secar alami di bumi, sebanyak 269 diantaranya belum terpantau secara menyeluruh.
Pada unsur kima, 80 dari unsur yang diketahui memiliki satu atau lebih isotope stabil. Unsur 43, 63, dan semu aunsur yang memiliki nomor atom lebih dari 82 tidak mempunyai isotope stabil. Hal ini yang menyebabkan unsur tersebut memiliki sifat radioaktif.
Massa Atom
Jumlah keseluruhan dari partikel dasar dalam suatu atom disebut nomor massa. Massa atom dalam keadaan diam dinilai dengan menggunakan satuan Dalton. Massa atom dalam unsur yang berbeda mempunyai massa yang bervariasi.
Massa ini tergantung atas jumlah proton dan neutron dalam intinya. Semakin besar massa atom, maka semakin kecil pula atom tersebut.
Nomor Atom
Atom-atom dalam zat yang berbeda mempunyai jumlah proton yang tidak sama dalam intinya. Jumlah proton dalam inti ini disebut nomor atom.
Gaya Atom
Gaya elektromagnetik menjaga elektron yang bermuatan negatif agar tetap berada orbit sekeliling inti muatan positif. Ada gaya tarik inti yang adalah gaya paling kuat yang menjaga proton dan neutron tetap berada dalam inti atom. Gaya inti seratus kali lebih kuat daripada gaya elektromagnetik.
Inilah pengertian Atom yang dapat mimin samaikan. Terimakasih telah mengunjungi blog kami di Sumberpengertian.id. Semoga artikel ini bermafaat yaa 🙂